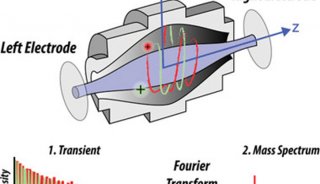
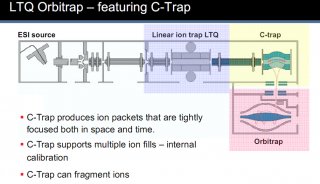
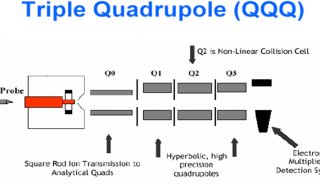
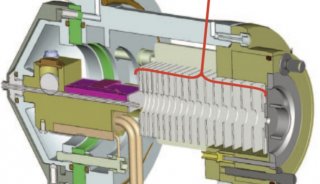
液質(zhì)聯(lián)用中的質(zhì)譜——串聯(lián)質(zhì)譜篇(下)
本文舉幾例常見(jiàn)的串聯(lián)質(zhì)譜儀,篇幅較長(zhǎng)分為上、中、下三篇。
串聯(lián)質(zhì)譜掃描方式
串聯(lián)質(zhì)譜的掃描方式包括以下幾種:
1、子離子掃描/產(chǎn)物離子掃描/碎片離子掃描(Product Ion Scan/Fragment Ion Scan):
選擇某一質(zhì)量的母離子進(jìn)入碰撞室,與碰撞室內(nèi)的碰撞氣體發(fā)生解離(CID或HCD),第二個(gè)質(zhì)量分析器進(jìn)行全掃描,得到的所有碎片離子都是由選定的母離子產(chǎn)生的子離子。如果是離子阱,則是分離出母離子,CID碰撞后,獲得所有的子離子譜。同時(shí),離子阱還可獲得MS3、MS4等n級(jí)的子離子掃描譜。主要用于化合物結(jié)構(gòu)分析。
2、母離子掃描/前體離子掃描(Parent Ion Scan/Precursor Ion Scan):
第二個(gè)質(zhì)量分析器被設(shè)定為固定檢測(cè)某一特定質(zhì)荷比的子離子,而由第一個(gè)質(zhì)量分析器掃描并檢測(cè)可經(jīng)解離產(chǎn)生此特定子離子的所有母離子,可篩檢具有相同子結(jié)構(gòu)的同系物,如鑒定多肽上是否含有特定的蛋白質(zhì)翻譯后修飾(PTM),或應(yīng)用于尋找藥物代謝物。
3、中性丟失掃描(Neutral Loss Scan):
兩個(gè)質(zhì)量分析器之間以相差一固定質(zhì)量(即中性碎片質(zhì)量)進(jìn)行同步掃描,而僅有在CID過(guò)程中丟失此固定質(zhì)量的離子方可被檢測(cè)到。因此中性丟失質(zhì)譜圖中顯示能產(chǎn)生特定中性碎片的母離子,也就是含有目標(biāo)官能團(tuán)的不同分子譜圖。
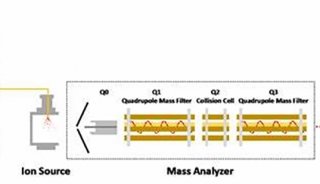
4、選擇反應(yīng)監(jiān)測(cè)(SRM或多反應(yīng)監(jiān)測(cè)MRM):
串聯(lián)質(zhì)譜儀中兩個(gè)質(zhì)量分析器均被用于檢測(cè)所選定的質(zhì)量而進(jìn)行掃描。此模式與單級(jí)質(zhì)譜中的選擇離子監(jiān)測(cè)(SIM)模式相似,差別在于SRM以第一個(gè)質(zhì)量分析器選擇特定母離子,由第二個(gè)質(zhì)量分析器監(jiān)控特定的子離子,通常是信號(hào)強(qiáng)度最高或包含有特征結(jié)構(gòu)新型的子離子。監(jiān)測(cè)多個(gè)母離子和子離子,叫做MRM。MRM是定量分析時(shí)最常用的方法。
5、DDA和DIA(或SWATH):
在子離子掃描MS/MS時(shí),一般儀器會(huì)自動(dòng)選擇執(zhí)行,常用DDA(Data Dependent Acquisition)和DIA(Data Independent Acquisition)兩種數(shù)據(jù)采集模式。DDA數(shù)據(jù)依賴(lài)采集模式,是最原始最簡(jiǎn)單的數(shù)據(jù)采集模式,在進(jìn)行一級(jí)質(zhì)譜分析后,根據(jù)設(shè)定的篩選條件(一般為離子強(qiáng)度的閾值Threshold)篩選母離子進(jìn)行二級(jí)質(zhì)譜分析,可獲得更多的碎片信息。該方法篩選目標(biāo)離子采用的窗口較窄,在一定上可減少干擾離子的存在,但是也會(huì)導(dǎo)致一些離子峰強(qiáng)度較高的離子被當(dāng)成目標(biāo)離子進(jìn)行二級(jí)質(zhì)譜分析,從而出現(xiàn)采樣不準(zhǔn)確、分析重復(fù)性較差的情況,因此,不太適合復(fù)雜樣本的分析。
DIA數(shù)據(jù)非依賴(lài)采集模式(SCIEX稱(chēng)為SWATH),是DDA模式的延伸和發(fā)展,DIA主要通過(guò)高低碰撞能量進(jìn)行一級(jí)質(zhì)譜和碎片信息的交替采集,不需要對(duì)母離子進(jìn)行篩選,利用若干個(gè)窗口對(duì)質(zhì)譜進(jìn)行全范圍掃描,對(duì)每個(gè)窗口中的所有離子進(jìn)行快速、循環(huán)選擇和檢測(cè),理論上可以獲得樣本中所有離子的全部碎片信息,提高了數(shù)據(jù)利用度,缺失值更少,分析重復(fù)性更高,更適合于大樣本和復(fù)雜樣本的分析檢測(cè)。

DDA和DIA的區(qū)別示意圖
6、PRM(平行反應(yīng)監(jiān)測(cè),Parallel Reaction Monitoring)

SRM和PRM對(duì)比示意圖
是目前靶向蛋白質(zhì)組學(xué)數(shù)據(jù)采集的主流方法,通過(guò)對(duì)特異性肽段或目標(biāo)肽段(如發(fā)生翻譯后修飾的肽段)進(jìn)行選擇性檢測(cè),從而實(shí)現(xiàn)對(duì)目標(biāo)蛋白質(zhì)/修飾肽段的靶向相對(duì)或絕對(duì)定量。PRM是一種基于高分辨、高精度質(zhì)譜的離子監(jiān)視技術(shù),能夠?qū)δ繕?biāo)蛋白質(zhì)、目標(biāo)肽段(如發(fā)生翻譯后修飾的肽段)進(jìn)行選擇性檢測(cè),從而實(shí)現(xiàn)對(duì)目標(biāo)蛋白質(zhì)/肽段的定量。首先利用四極桿質(zhì)量分析器的選擇檢測(cè)能力,在一級(jí)質(zhì)譜中選擇性地檢測(cè)目標(biāo)肽段的母離子信息。隨后,在碰撞池中對(duì)母離子進(jìn)行碎裂;最后利用高分辨、高質(zhì)量精度分析器在二級(jí)質(zhì)譜中檢測(cè)所選擇的母離子窗口內(nèi)的所有碎片的信息。這樣即可對(duì)復(fù)雜樣本中的目標(biāo)蛋白質(zhì)/肽段進(jìn)行準(zhǔn)確地特異性分析。
上述幾種是主要的質(zhì)譜掃描方式,各質(zhì)譜公司根據(jù)各自質(zhì)譜產(chǎn)品的特定,還會(huì)有特定的一些掃描模式,并給以不同的名稱(chēng)。
離子活化/解離模式
獲得MS/MS或MSn需要進(jìn)行離子活化/解離,大部分應(yīng)用中都用CID,只是蛋白質(zhì)組等組學(xué)應(yīng)用中需要其它幾種模式,解離模式包括以下幾種:
1.碰撞誘導(dǎo)解離(Collison-Induced Dissociation,CID)
是最常見(jiàn)的產(chǎn)生碎片離子的方式,在碰撞室或離子阱/FTICR中發(fā)生。它包括兩個(gè)連續(xù)步驟:首先是快速移動(dòng)的離子與目標(biāo)分子(通常為惰性氣體)間的碰撞,離子達(dá)到振動(dòng)激發(fā)態(tài);第二個(gè)步驟是激發(fā)態(tài)離子進(jìn)行自解離的過(guò)程。又分為高能CID和低能CID,前者常見(jiàn)于配置磁場(chǎng)、電場(chǎng)分析器或TOF分析器等的串聯(lián)質(zhì)譜儀上,后者常用于三重四極桿、離子阱或FTICR串聯(lián)質(zhì)譜儀上。
2.高能碰撞解離(High Energy Collision Dissociation, HCD)
HCD專(zhuān)指Orbitrap類(lèi)儀器中離子在高能碰撞池或多級(jí)離子通道中的碎裂方式,相比于CID碎裂方式能獲得低m/z的碎片離子,產(chǎn)生的碎片相對(duì)更多,譜圖質(zhì)量更高。

肽段CID/HCD的碎片裂解模式
3.電子捕獲解離(Electron Capture Dissociation,ECD)
ECD應(yīng)用于帶正電荷的正離子解離上,正離子與陰極發(fā)射出的低能量電子束(常小于0.2 eV)間發(fā)生交互作用,多電荷的正離子可通過(guò)捕獲電子,降低其所帶正電荷數(shù)并產(chǎn)生自由基正電子進(jìn)而誘導(dǎo)解離。由于活化過(guò)程非常快速,可觀察到直接的化學(xué)鍵斷裂, ECD僅僅適用于FTICR,因?yàn)镋CD前離子需位于高密度的熱電子環(huán)境中。
ECD主要產(chǎn)生由 N—C α鍵的斷裂而形成的 c 和 z 類(lèi)型離子;由于骨架鍵的斷裂發(fā)生在振動(dòng)能量重新分布之前,ECD可以很好地保留非共價(jià)鍵以及弱的翻譯后修飾鍵信息;同時(shí)ECD的斷裂位點(diǎn)只取決于電子捕獲的位點(diǎn)而不考慮分子鍵能的高低,可以產(chǎn)生的碎片離子更加豐富,可與CID/HCD碎裂模式形成互補(bǔ)。
4.電子轉(zhuǎn)移解離(Electron Transfer Dissociation, ETD)和電子活化解離(Electron Activated Dissociation, EAD )
ETD、EAD的碎裂行為和ECD類(lèi)似,都是主要生成c、z離子。其中ETD模式在離子阱中將一個(gè)電子從引入的陰離子基團(tuán)轉(zhuǎn)移到肽陽(yáng)離子上引起肽段碎裂,因此稱(chēng)之為電子轉(zhuǎn)移解離;帶負(fù)電的蒽離子(Anthracene Anion)與偶氮苯離子(Azobenzene Anion)最常被用于ETD。
相比于傳統(tǒng)的CID/HCD解離,ECD/ETD/EAD可以降低蛋白酶解的依賴(lài)性,能夠很好地裂解帶有更高電荷的大片段肽段和完整蛋白,得到幾乎完全斷裂的肽段,也能獲得豐富的c、z序列離子,并且保留蛋白質(zhì)或肽段上帶有的修飾基團(tuán),如磷酸化修飾、N-和O-糖基化修飾、磺化修飾等,對(duì)蛋白質(zhì)翻譯后修飾和Top-down蛋白質(zhì)組學(xué)研究起到了有利的推動(dòng)作用。

ECD/ETD/EAD的碎片裂解模式
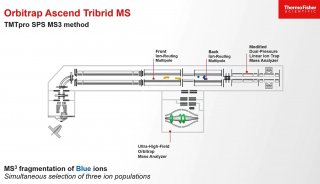
然而該種模式解離帶有高電荷大片段肽段和完整蛋白時(shí),得到的碎裂肽段帶電荷一般很高,譜圖復(fù)雜難以解析,在ETD反應(yīng)體系中加入能與高電荷肽段發(fā)生質(zhì)子轉(zhuǎn)移電荷減少反應(yīng)(Proton Transfer Charge Reduction,PTCR) 的陰離子,將高電荷的解離產(chǎn)物轉(zhuǎn)化為較低電荷態(tài),簡(jiǎn)化譜圖有助于譜圖解析,PTCR技術(shù)也已用在成熟的商品化質(zhì)譜儀中,如賽默飛三合一儀器——Orbitrap Eclipse和Orbitrap Ascend,這兩款儀器用于質(zhì)子轉(zhuǎn)移的陰離子為全氟 (十四氫菲)離子。
接下來(lái)請(qǐng)見(jiàn)下篇:液質(zhì)聯(lián)用中的質(zhì)譜:檢測(cè)器
目錄:
前言:液質(zhì)聯(lián)用(LC-MS)簡(jiǎn)述
Chapter1、液質(zhì)聯(lián)用中的液相色譜
Chapter2、液質(zhì)聯(lián)用中的質(zhì)譜
2.1離子源
2.2離子傳輸
2.3 質(zhì)量分析器
2.4串聯(lián)質(zhì)譜(Tandem Mass Spectrometry,MS/MS)
2.5 檢測(cè)器
2.6 真空系統(tǒng)
Chapter3、液質(zhì)聯(lián)用中的數(shù)據(jù)采集和分析
-
企業(yè)風(fēng)采
-
綜述

-
綜述